


Next: Valovastesignaalin mallit
Up: Mittausten tavoitteet
Previous: Yleistä
Pimeävirran muutos valosalaman seurauksena on luonteeltaan kuvan
2.3(b) mukainen signaali. Vaste nousee maksimiinsa nopeasti
valosalaman jälkeen ja palaa hitaammin takaisin nollatasolle. Usein
vasteista halutaan tietää vain amplitudiparametri: pimeävirran
maksimipoikkeama nollatasosta.![[*]](foot_motif.gif) Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
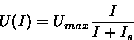
missä Umax on vasteen saturoitunut maksimi (suurin mahdollinen
vaste) ja Is on se intensiteetti, jolla saadaan maksimin puolikkaan
suuruinen vaste eli U(Is) = Umax/2. Yhtälön määrittämää kuvaajaa
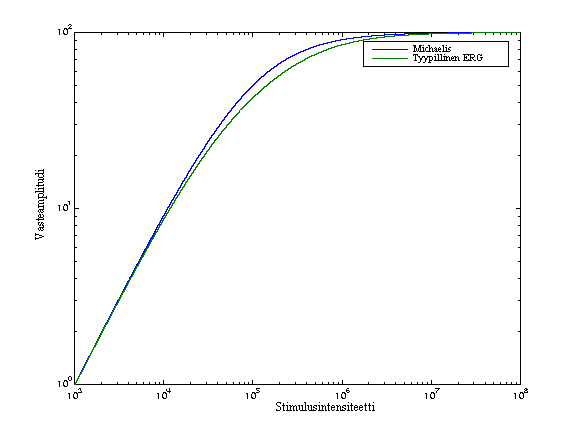
kutsutaan yleisesti solun toimintakäyräksi. Toimintakäyrä
esitetään yleensä loglog-asteikolla kuvan
2.7 mukaisesti. Kuten kuvasta nähdään heikoilla
stimuluksilla vasteen amplitudi riippuu likimain lineaarisesti
intensiteetistä. Voimakkailla stimuluksilla vaste saturoituu, jolloin
stimuluksen kasvattaminen ei enää kasvata vastetta.
Kuva 2.7:
Michaelis-yhtälön mukainen stimulus/vaste -käyrä sekä
tyypillinen eristetystä verkkokalvosta saatava käyrä ovat hyvin
lähellä toisiaan. Amplitudiakselin arvot ovat prosentteja maksimista.
Intensiteettiakselin yksikkö on valittu mielivaltaisesti.
 |
Mittaamalla näköreseptorin vaste kahdella eri intensiteetillä, voidaan
yhtälön parametrit Umax ja Is määrittää ja siten määrätä myös
solun toimintakäyrä. Toimintakäyrää käytetään yleisesti solun
fysiologisen tilan mittarina. Erityisesti Is muuttuu solun
adaptaatiotilan mukaan, joten sitä voidaan käyttää parametrina, joka
kertoo solun herkkyyden. Herkkyys määritellään yleensä
toimintakäyrän lineaarisella alueella stimuluksen voimakkuuden ja
stimuluksen seurauksena saadun vasteen suuruuden suhteena. Sauvasolun
herkkyys voidaan siis määritellä seuraavasti:
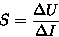
Kun intensiteetin annetaan lähestyä nollaa, saadaan Michaelis-yhtälön
mukaan:
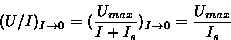
Herkkyys saa siis muodon:
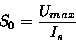
Todelliset valovasteet - erityisesti kokonaisesta verkkokalvosta
mitatut - voivat poiketa hieman Michaelis-yhtälöstä. Syynä tähän
ERG-mittauksilla on pääasiassa glia-solujen tuottama kontribuutio
valovastesignaaliin. Syynä voi olla myös esimerkiksi preparaatin nopea
adaptaatio, jolloin preparaatti valoadaptoituu jo stimulusvalon
seurauksena. Tällöin preparaatin vaste voimakkaalle, muttei
saturoivalle stimulukselle on pienempi kuin Michaelis-yhtälön
ennustama vaste. Mittauksissa kokonaisella verkkokalvolla eri
reseptorit saattavat myös saada hieman erilaisen stimuluksen tai
reseptoreiden adaptaatiotila voi vaihdella. Tällöin heikoilla
stimuluksilla kaikki reseptorit ovat toimintakäyriensä lineaarisella
alueella tai ainakin lähellä sitä. Toisaalta voimakkailla
stimuluksilla kaikki reseptorit ovat lähes saturaatiossa. Näin ollen
summautuvat vasteet heikoilla ja voimakkailla stimuluksilla voivat
olla malliin hyvin sopivia keskiarvoja, mutta toimintakäyrän keskiosa
voi vääristyä.
Yleensä mitatut toimintakäyrät ovat loivempia kuin Michaelis-yhtälö
ennustaa. Kokeellisten tulosten poikkeamista ideaalisesta pyritään
yleisesti kompensoimaan ad hoc -malleilla, jotka ovat
Michaelis-yhtälön yleistyksiä. Usein käytetty yleistys on
potenssikorjaus:
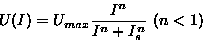
Kaavassa n on parametri, joka säätää toimintakäyrän jyrkkyyttä.
Parametrin n arvolla yksi kaava yhtyy Michaelis-yhtälöön. Kaava
sopii yleensä hyvin kokeellisiin tuloksiin, mutta kaavalla ei ole
minkäänlaista teoreettista pohjaa. Toinen huomattavasti oleellisempi
vika kaavassa on se, että vasteilla ei ole lineaarista aluetta
pienillä stimuluksilla. Intensiteetin lähestyessä nollaa, vasteen ja
stimulusintensiteetin suhde lähestyy ääretöntä:
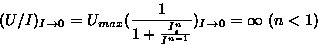
Potenssikorjaus romuttaa siis varsin oleellisen herkkyysparametrin.
Yllättävän vähän käytetty z-funktio sopii hyvin kokeellisiin
tuloksiin ja antaa pienille stimuluksille linearisen vasteen:
[5]
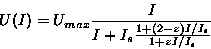
Tässä kaavassa z on säädettävä parametri ja parametrin arvolla yksi
kaava yhtyy Michaelis-yhtälöön. Kun intensiteetti lähestyy nollaa
saadaan stimuluksen ja vasteen suhteeksi:
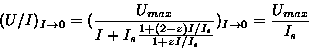
Herkkyys pienille stimuluksille on siis samaa muotoa kuin
Michaelis-yhtälön tapauksessa. Tosin parametri Is on z-funktiossa
hieman pienempi kuin puolimaksimin antava intensiteetti, jos z on
pienempi kuin yksi:
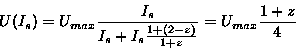
Molemmissa malleissa on yksi säädettävä korjausparametri. Jos
mitattuja vasteita halutaan sovittaa esitettyihin malleihin, tarvitaan
vastemittauksia siis ainakin kolmella stimulusintensiteetillä.
Jos pimeäadaptoitunutta valoreseptoria valaistaan taustavalolla, Is
kasvaa voimakkaasti, eli solu menettää herkkyyttään. Sama ilmiö
tapahtuu transientisti myös stimulussalamien seurauksena. Tästä ja
muista syistä johtuen mittausten kohteena olevan preparaatin
toimintakäyrä muuttuu yleensä koko mittauksen ajan. Koska
preparaatista voidaan kullakin ajanhetkellä mitata vaste vain yhdelle
intensiteetille ja toimintakäyrän määrittämiseksi tarvitaan vaste
kahdelle tai useammalle eri intensiteetille, hetkellisen
toimintakäyrän suora mittaaminen on mahdotonta. Toimintakäyrän
hetkelliset parametrit voidaan kuitenkin estimoida mittaamalla
preparaatin vaste kahdelle tai useammalle intensiteetille
mahdollisimman säännönmukaisessa sekvenssissä. Yleensä
stimulussekvenssi on seuraavanlainen:
- 1.
- Valosalama pienellä intensiteetillä.
- 2.
- Tauko, jonka aikana pimeävirta palaa normaalitasolle.
- 3.
- Valosalama noin puolimaksimin antavalla intensiteetillä.
- 4.
- Tauko, joka on yleensä hieman pidempi kuin kohdassa
2.
- 5.
- Valosalama intensiteetillä, joka antaa lähes maksimivasteen.
- 6.
- Tauko, joka on yleensä huomattavasti pidempi kuin kohdissa
2 ja 4.
Stimuluksen jälkeisen tauon tulee olla yleensä sitä pidempi, mitä
suurempi valosalaman intensiteetti, koska pimeävirran paluu
normaalitasolle tapahtuu sitä hitaammin mitä suurempi stimuluksen
intensiteetti. Kun vasteita on mitattu esitetyn sekvenssin mukaisesti,
voidaan toimintakäyrä määrittää esimerkiksi pienstimulusten
ajanhetkillä interpoloimalla muiden intensiteettien antamat vasteet
edeltävien ja seuraavien vasteiden perusteella kyseiselle
ajanhetkelle.



Next: Valovastesignaalin mallit
Up: Mittausten tavoitteet
Previous: Yleistä
Antti Miettinen
9/3/1997

![[*]](foot_motif.gif) Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
![[*]](foot_motif.gif) Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
Maksimipoikkeama U stimuloivan valosalaman intensiteetin I
funktiona noudattaa varsin hyvin Michaelis-yhtälöä:
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()