|
|
|
|

|

|

|
|
Artikkelissa [8] esiteltiin sauvasolun pH-säätelymekanismien tutkimustuloksia. Työn mittaukset tehtiin imupipettimittauksina, joissa sauvasolun sisä- ja ulkojäsen altistettiin erilaisille ionivaihtajien toimintaan vaikuttaville kemikaaleille.
Sauvasolun solukalvossa on oletettavasti ionivaihtajia, jotka pyrkivät pitämään solun sisä-pH:n solun toiminnan kannalta sopivalla tasolla. Jos solua huuhtelevaan liuokseen lisätään kemikaaleja, jotka estävät näiden ionivaihtajien toiminnan, solun pH-tason tulisi muuttua. Pimeävirtaa ja valon pimeävirtaan aiheuttamaa vastetta voidaan käyttää epäsuorana mittarina ainakin sauvasolun ulkojäsenen pH:lle. Useissa töissä on havaittu, että sauvasolun pimeävirta ja valovasteet pienenevät ulkojäsenen happamoivan käsittelyn seurauksena ja kasvavat alkalisoivan käsittelyn seurauksena. Näin ollen pH-säätelyä hoitavia ionivaihtajia voidaan tutkia seuraamalla pimeävirran absoluuttista tasoa ja valostimulusten aiheuttamaa vastetta pimeävirrassa.
Työssä havaittiin, että sauvasolun sisä- ja ulkojäsenten pH-säätelymekanismit poikkeavat toisistaan merkittävästi. Huuhdeltaessa sisäjäsentä Na+/H+ -vaihtajien tai HCO3-/Cl- -vaihtajien toimintaa inhiboivilla kemikaaleilla huomattiin, että valon aiheuttama vaste pimeävirrassa hävisi, mutta solun pimeävirta ei. Tämä havaittiin rekisteröimällä pimeävirtaa solusta, joka ei kemikaalikäsittelyn jälkeen enää reagoinut valolle. Rekisteröinti tapahtui ilman valostimuluksia ja solua liikuteltiin imupipetissä edestakaisin, jolloin muuttuva osuus pimeävirrasta virtaa mittauselektroniikan kautta. Jos solun pimeävirta olisi kokonaan hävinnyt, solun liikuttelun ei tulisi aiheuttaa muutosta mitatussa signaalissa. Toisaalta huomattiin myös, että mittauksessa, jossa useamman minuutin aikana rekisteröitiin signaalia ja annettiin preparaatille valostimuluksia, valostimulukset eivät kemikaalin lisäämisen jälkeen kyenneet viemään pimeävirtaa nollatasolle kuten ennen kemikaalin lisäystä. Toisaalta sama bikarbonaattivaihtajien toimintaa inhiboiva kemikaali, joka sisäjäseneen kohdistettuna aiheutti valovasteiden häviämisen, kasvatti valovasteita kohdistettuna ulkojäseneen. Tämä voidaan selittää sillä, että kyseinen vaihtaja ajaa normaalitilassa HCO3--ioneja ulos solun ulkojäsenestä ja vaihtajan inhibointi saa aikaan pH:n nousun.
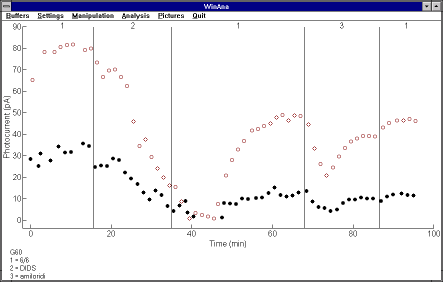
Myös tässä työssä rekisteröinti- että analyysisovellusten ominaisuuksia hyödynnettiin runsaasti. Esimerkiksi julkaisun kuvista lähes kaikki laadittiin kokonaan analyysisovelluksella. Osa kuvista vietiin analyysisovelluksesta Windowsin leikepöydän kautta tekstien ja symboleiden lisäämistä varten tehtävään soveltuvaan piirtosovellukseen ennen lopullisen kuvan tulostamista. Kuvassa 5.1(c) on näkymä analyysisovelluksen pääikkunasta, jossa on esitetty yhden kokeen kahden stimulusintensiteetin vasteiden amplitudiarvot ajan funktiona. Tässä kokeessa sauvasolun ulkojäsen oli imupipetin sisällä. Kuvaajasta nähdään selkeästi valovasteiden amplitudiarvojen lasku, kun sisäjäsentä huuhdellaan ionivaihtajien toimintaa ehkäisevällä kemikaalilla (DIDS ja amiloridi).